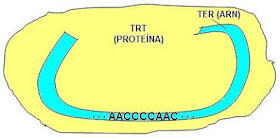
La telomerasa es un enzima formado por un complejo proteína-ácido ribonucleico con actividad polimerasa que está presente en células de la línea germinal, en tejidos fetales y en ciertas células madre poco diferenciadas, y que permite el alargamiento de los telómeros. También se encuentra presente en organismos eucariotas unicelulares. La telomerasa es reprimida en las células somáticas maduras después del nacimiento, produciéndose un acortamiento del telómero después de cada división celular.
Tres estadounidenses, Elizabeth Blackburn, Carol W. Greider y Jack W. Szostak, acaban de ser galardonados con el Nobel de Medicina por el descubrimiento de una enzima que ayuda a mantenerse jóvenes a los cromosomas en las células, según informó el comité.
Los científicos recibieron el premio por sus trabajos sobre la telomerasa, una enzima que "protege a los cromosomas contra el envejecimiento", explicó el comité en su anuncio del galardón. Se conoce como télomeros a la parte final, la punta, de los cromosomas. Los telómeros funcionan como un reloj en la vida celular y se reducen con cada división de la célula, alcanzando eventualmente un tamaño mínimo que señala el cese de la división “Si los telómeros se acortan, las células envejecen”, explica el comité del Nobel. Por el contrario, si la actividad de la telomerasa es alta, la longitud del telómero se mantiene, y la senescencia celular se retrasa”. Este es el caso de las células cancerígenas, con largos telómeros y gran actividad de la enzima telomerasa, a las que se atribuye “vida eterna”.
El descubrimiento de su funcionamiento podría ser la clave de la "eterna juventud", ya que podría tener implicaciones no sólo en el cáncer, sino en los trasplantes, el SIDA y ciertas enfermedades hereditarias.
Telomerasa y Senescencia
Recientes estudios con este enzima han demostrado que la introducción de telomerasa en células somáticas produce la regeneración de los telómeros. Es decir, anula el proceso de envejecimiento y muerte celular. En 1998, Bodnar y col. introdujeron en dos tipos de células humanas normales (sin actividad telomerasa) el gen que codifica la telomerasa. En contraste con las células normales que mostraban senescencia y un acortamiento de los telómeros, los clones que expresaban la TERT mostraron telómeros elongados, se dividían vigorosamente y mostraron una reducción de la beta–galactosidasa, un biomarcador de la senescencia. Las células transformadas para expresar la TERT mostraron un cariotipo normal y su longevidad ha superado la normal en más de 20 divisiones.
Se ha demostrado que el acortamiento telomérico aumenta proporcionalmente con el número de divisiones o con la edad del organismo eucariótico. Además los enfermos con síndromes de envejecimiento prematuro presentan una acelerada pérdida de telomerasa.
Además de las anteriores, podemos concluir, a modo de resumen, una serie de pruebas generales que demuestran que el acortamiento de los telómeros está implicado en el envejecimiento y senescencia:
-Los telómeros se alargan durante el desarrollo temprano. En las células del embrión, los telómeros pueden llegar a ser más largos que los del cigoto debido a que la telomerasa está activa.
-Los telómeros se alargan durante el desarrollo temprano. En las células del embrión, los telómeros pueden llegar a ser más largos que los del cigoto debido a que la telomerasa está activa.
-La línea germinal presenta la telomerasa activa. Los gametos formarían un cigoto con una suficiente longitud telomérica para poder llevar a cabo su proliferación.
-Las células madre presentan telomerasa activa. Debido a la necesidad de autoperpetuación de las células madre, necesitan ser capaces de mantener los telómeros con una longitud adecuada para que no se produzcan daños en el ADN.
-Las células madre presentan telomerasa activa. Debido a la necesidad de autoperpetuación de las células madre, necesitan ser capaces de mantener los telómeros con una longitud adecuada para que no se produzcan daños en el ADN.
El acortamiento telomérico de las células somáticas está relacionado linealmente con su capacidad proliferativa. Los telómeros de las células diferenciadas serán más cortos en células que se hayan divido más veces que los de células másjóvenes. Además, las células de organismos de edad más avanzada se dividen menos veces que las células de organismos de menor edad.
La células que han sufrido una transformación suelen presentar actividad telomerasa. Nos referimos a células transformadas en laboratorio para mantenerse indefinidamente en cultivo, y a las células cancerosas que también se autoperpetúan.
Esto podría conducir a tratamientos con telomerasa que evitarían por completo la muerte, tanto celular como del individuo, es decir, sería el fármaco que otorgaría la inmortalidad, salvo por un contratiempo: Al administrar telomerasa a seres pluricelulares complejos como los humanos o animales, la célula empieza a dividirse indefinidamente, es decir, crea un tumor maligno que se divide a gran velocidad y, teniendo en cuenta que evita el envejecimiento pero no los demás males, provocaría la muerte por cáncer.
Telomerasa y Cáncer
Estudios recientes sugieren que podríamos revertir el proceso de senescencia incrementando de forma artificial la cantidad de telomerasa en nuestras células. Incluso se podrían revertir algunas atrofias de nuestros tejidos debidas a la vejez, induciendo la síntesis de telomerasa. Sin embargo hay que considerar una consecuencia indirecta de alterar los genes de la inmortalidad celular: el cáncer, ya que las células cancerosas, a diferencia de las células somáticas normales, no tienen senescencia tras un número definido de divisiones.
Algunos estudios demuestran que cuando se estimula la actividad telomerasa y se inactiva un gen supresor de tumores (el gen p16INK4a) se produce inmortalización celular, lo cual constituye un importante paso hacia la formación de un tumor.
Muchas células cancerosas derivan de células somáticas, y se ha comprobado la presencia de telomerasa en el 75-80% de las líneas tumorales. Esto no quiere decir que la telomerasa induzca el cáncer. Es más, Kathleen Collins de la Universidad de Berkeley en California encontró que enfermos con una enfermedad congénita muy poco frecuente, la disqueratosis congénita, tenían niveles de telomerasa anormalmente bajos, muriendo no obstante en muchos casos de cáncer gastrointestinal. A pesar de esta incongruencia, se sabe que la agresividad de las células tumorales está relacionada con sus niveles de telomerasa y que los niveles altos de este enzima son indicativos de la malignidad del tumor.
Recientemente la FDA ha autorizado dos estudios clínicos con telomerasa, uno de ellos encaminado a obtener un mejor diagnóstico del cáncer cervical y el otro para evaluar un fármaco contra la leucemia mieloide. En Japón se está utilizando en niños con neuroblastoma 4S. Al parecer estos niños tienen un cáncer metastásico, pero los tumores no tienen telomerasa y aproximadamente el 80% llegan a una remisión espontánea una vez que el tumor se ha eliminado quirúrgicamente. El estudio identifica los que son positivos para telomerasa, de manera que se los puedan tratar de una manera más agresiva, de hecho, en la actualidad, una importante línea de investigación frente al cáncer se basa en la telomerasa como diana frente al cáncer. Geron Corporation está desarrollando estos medicamentos anti–telomerasa contra el cáncer, dando buenos resultados en células cancerosas en cultivo. Las células tratadas reducen sus telómeros y mueren tras aproximadamente 25 divisiones.
Las células tumorales inmortales pueden ser útiles para inmortalizar células somáticas mediante hibridación celular somática. Esto se consigue mediante la fusión de los citoplasmas de una célula tumoral y una célula somática en cultivo. Esta técnica se emplea para diferentes fines como puede ser el determinar la ubicación cromosómica de un gen, o para la obtención de algún producto específico como un anticuerpo frente a un determinante antigénico.
WIKIPEDIA
WIKIPEDIA
***************
La leucemia mieloide crónica (o LMC) es un cáncer de la sangre en el que la médula ósea produce demasiados granulocitos, un tipo de glóbulo blanco. Se clasifica dentro de los síndromes mieloproliferativos crónicos.
En condiciones normales, las células madre de la médula ósea maduran hasta convertirse en los diferentes tipos de células de la sangre. En la LMC las células madre tienen una alteración que se transmite a toda su descendencia pero es en los granulocitos donde más se expresa. Éstos se producen de forma incontrolada, invadiendo la médula ósea y el resto del organismo, impidiendo la normal fabricación del resto de las células de la sangre y alterando el funcionamiento de diversos órganos.
La leucemia mieloide crónica se desarrolla en tres fases: una inicial, o fase crónica, en la que el exceso de producción de granulocitos es fácilmente controlable; una segunda fase o de aceleración, en la que empieza a ser difícil controlar la enfermedad y, una tercera o fase blástica, en la que se transforma en leucemia aguda.
La LMC predomina entre los adultos (edad media 50 años) y es poco frecuente en niños. Cada año se diagnostican alrededor de 15 nuevos casos por millón de habitantes.
Principales síntomas
En el 60% de los pacientes la enfermedad se diagnostica por una analítica rutinaria. El paciente puede permanecer totalmente asintomático durante muchos años. En el resto, los principales síntomas son: debilidad, fatiga persistente, fiebre, sudación, pérdida de peso, anemia, hemorragias, hematomas no justificados, pequeñas infecciones, dolores en huesos y articulaciones. Muchos pacientes presentan además sensación de ocupación en el lado izquierdo del abdomen como consecuencia del crecimiento de tamaño del bazo. Todos estos síntomas suelen controlarse rápidamente al recibir el tratamiento y el paciente puede permanecer asintomático hasta que se produzca la progresión de la enfermedad antes mencionada.
Estudio
El diagnóstico de LMC se basa en el aumento de granulocitos en la sangre y médula, y en la demostración de una alteración característica en los cromosomas de las células sanguíneas, el denominado cromosoma Filadelfia, o de la alteración génica que origina la enfermedad, el denominado gen bcr/abl. Para efectuar estos estudios es necesario analizar de forma detallada tanto la sangre como la médula ósea por lo que deberán efectuarse diversas extracciones de sangre y de médula ósea, obtenida esta última mediante punción del esternón o el hueso de la cadera. Finalmente deberá realizarse una biopsia medular (obtención de un pequeño cilindro del hueso de la cadera) para poder estudiar la arquitectura de la médula ósea.
Tratamiento
El tratamiento dependerá de la fase en que se encuentre la enfermedad y de la edad del paciente. Por su extraordinaria efectividad los inhibidores de la tirosin-quinasa (ITK) se han convertido en pocos años en el tratamiento de primera línea de la LMC. En los pacientes con cifras iniciales deleucocitos muy elevadas es habitual administrar hidroxiureadurante unos días para reducir estas cifras y poco después iniciar el tratamiento con un ITK. El más habitualmente empleado es el imatinib (Glivec®), reservándose los otros dos agentes comercializados hasta la actualidad (dasatinib -Sprycell®- y nilotinib - Tasigna®-) para el tratamiento de segunda línea en los pacientes que no responden a imatinib.
Estos agentes consiguen el total control de la enfermedad en casi el 90% de los pacientes y esta respuesta se suele mantiene durante muchos años, siendo frecuentes las respuestas moleculares (desaparición en mayor o menor grado del bcr/abl en los controles de seguimiento). Esta efectividad y su escasa toxicidad han hecho que estos agentes, a pesar de no permitir la curación de la enfermedad, hayan desbancado totalmente al trasplante alogénico de médula ósea como tratamiento inicial de la LMC.
Si bien el trasplante permite la curación de la enfermedad en el 50-70% de los pacientes se trata de un procedimiento asociado a una considerable morbi-mortalidad. Por ello se le reserva para los pacientes en fases avanzadas de la enfermedad o para aquellos que no responden o pierden la respuesta a los ITK.
En los pacientes en estas circunstancias con una edad inferior a 60-65 años debe valorarse si existe algún hermano histocompatible o, en caso de no existir, proceder a localizar un donante compatible no familiar mediante una búsqueda internacional de donante voluntario no emparentado.
Fundación Internacional Josep Carreras
Fundación Internacional Josep Carreras
*************
"La telomerasa es importante en el cáncer
y en el envejecimiento"
y en el envejecimiento"
María Blasco (Alicante, 1965), directora del programa de Oncología Molecular del Centro Nacional de Investigaciones Oncológicas, está acostumbrada a recibir premios internacionales y a abrir brecha con la ciencia hecha en España. El último reconocimiento en sumarse a su lista personal ha sido el que concede la Organización Europea de Biología Molecular (EMBO) al mejor investigador europeo menor de 40 años, dotado con 10.000 euros. Blasco regresó a España en 1997 al Centro Nacional de Biotecnología (Madrid), después de una estancia en el Cold Spring Harbor Laboratory (EE UU). Tres años más tarde, en 2001, se trasladó al puesto que ocupa en la actualidad.
Pregunta: Usted es la primera investigadora española en recibir el premio EMBO. ¿Cómo valora este hito?
"La aplicación obvia es en enfermedades de envejecimiento prematuro" "Ya sabemos que no será posible tener una receta única para todos los tumores"
"La aplicación obvia es en enfermedades de envejecimiento prematuro" "Ya sabemos que no será posible tener una receta única para todos los tumores"
Respuesta. Quiere decir que en España se hace una ciencia que es del mismo nivel que la que se hace en el resto de Europa. Quizá no tanto en cuanto a la cantidad de investigación, que en España es claramente menor debido a la menor inversión por parte del Gobierno, sino en cuanto a la calidad de la producción científica y a la aparición de nuevas líneas de investigación. A este premio accedían normalmente científicos ingleses, franceses o alemanes, muchos de los cuales trabajan en el Instituto Europeo de Biología Molecular (EMBL) en Alemania; que me hayan dado el premio a mí refleja que en España se hace buena ciencia.
P. Usted no sólo es el primer español, de forma genérica, sino la tercera mujer europea que lo consigue. ¿Por qué este escaso reconocimiento a las científicas?
R. No creo que refleje una discriminación hacia las mujeres, sino el hecho de que hay muchos menos laboratorios dirigidos por mujeres que por hombres. Desde luego pone de manifiesto un problema real y que preocupa a la comunidad científica.
P. Su trabajo se centra en los telómeros [los extremos de los cromosomas] y la enzima que los controla, la telomerasa. ¿Cuál es su papel en el cáncer?
R. Se cree que la telomerasa es uno de los pilares que sostienen el crecimiento tumoral. En la base de ello se encuentran los mecanismos que hacen que una célula mortal se convierta en una célula inmortal. Esta última puede dividirse indefinidas veces permitiendo el crecimiento del tumor, mientras que la mortal no. Lo que le confiere la capacidad de multiplicarse indefinidamente y traspasar los límites normales de vida celular es la actividad de la telomerasa.
A medida que una célula normal se divide va perdiendo fragmentos de los telómeros, lo que provoca una disminución progresiva de funcionalidad y en última instancia la muerte. Este proceso explica por qué las células normales son mortales. Sin embargo, las células tumorales escapan al destino de tener los telómeros cada vez más cortos aumentando los niveles de telomerasa. Esto ocurre en más del 95% de todos los tipos de tumores humanos, lo cual es una clara indicación de que es algo esencial para que el tumor crezca. De hecho, ya se ha demostrado que células tumorales cultivadas en el laboratorio a las que se les quita la telomerasa mueren rápidamente debido a un agotamiento de sus telomeros.
P. El presidente de EMBO ha afirmado que su contribución a la investigación del cáncer es "incuestionable". ¿Cuál es exactamente su aportación?
R. Mi mentora en Estados Unidos, Carol Greider, fue la que descubrió la telomerasa y fue allí donde yo empecé a trabajar sobre ella. Mi contribución ha sido en realidad demostrar la importancia de esta enzima en el cáncer y en el envejecimiento. Lo que yo hice fue crear un modelo animal en el que quitaba o ponía telomerasa, de este modo se comprueba que cuando se elimina, los ratones envejecen prematuramente y tienen menos cáncer. Por el contrario, cuando se aumenta la cantidad de telomerasa se favorece la proliferación de los tumores.
P. Como ha dicho la telomerasa es uno de los pilares del cáncer, pero existen otros muchos como los oncogenes, los supresores tumorales, etcétera. ¿Cómo se conectan todos los interruptores moleculares del cáncer a la hora de tratar a un paciente?
R. Ésta es la fase en la que estamos ahora y que tiene que dar los mayores frutos en los próximos años. La oncología molecular, es decir, estudiar y conocer las bases moleculares del cáncer, es algo que se está haciendo desde hace 20 años. Ahora podemos decir que sabemos qué es el cáncer, cómo se genera y cuáles son los procesos que tenemos que atacar. El salto al paciente está mediado necesariamente porque haya otro grupo de investigadores que busque fármacos dirigidos a estos procesos. Los oncólogos moleculares hemos identificado ya algunas de las dianas a las que hay que atacar. Quienes se encargan de buscar los fármacos son fundamentalmente las compañías farmacéuticas y son ellas las que deben invertir en diseñar nuevos tratamientos. En estos momentos hay pocos fármacos de los que se utilizan en la clínica que estén basados en la oncología molecular. En la actualidad se usan los mismos tratamientos que se utilizaban cuando no se conocía nada del cáncer. Son sustancias cuyo cometido es destruir la célula y atacan principalmente a las tumorales porque se dividen más, pero también afectan a las normales.
P. Y en lo que se refiere al tratamiento del paciente, ¿en qué se va a notar la influencia de la oncología molecular?
R. En cada tipo de cáncer se verá qué tiene más preponderancia un proceso u otro (telomerasa, oncogenes, formación de nuevos vasos sanguíneos que alimentan el tumor) y se utilizarán los fármacos adecuados para atacar las características moleculares del tumor. Desde luego, será mucho más complicado que el tratamiento que se hace por ejemplo para el sida. No será posible tener una receta única para todos los tumores.
P. ¿Existen ya fármacos en investigación basados en sus hallazgos sobre la actividad de la telomerasa?
R. Lo que está más avanzado hasta el momento no es el tratamiento clásico constituido por una pequeña molécula dirigida a una diana concreta, sino que es lo que se conoce como inmunoterapia, cuyo objetivo es estimular el sistema de defensa para que ataque las células que tienen mucha telomerasa, es decir las células tumorales, pero no las normales. En lo que se refiere al concepto de fármaco tradicional hay una compañía en Alemania y otra en San Francisco (EE UU) que ya tienen agentes que atacan directamente a la telomerasa.
P. Puesto que las células normales también tienen telomerasa, un tratamiento que la elimine no será específico para el tumor, sino que afectará al resto de los tejidos.
R. Sí, las células normales también tienen la enzima, pero no dependen de ella para vivir como ocurre con las cancerosas. En cualquier caso, los efectos secundarios tendrán que verse haciendo ensayos clínicos.
P. La telomerasa también participa en los procesos de envejecimiento. ¿Se están desarrollando terapias para retrasar o detener la senectud?
R. Hay mucho interés en este campo. La aplicación más obvia es en enfermedades de envejecimiento prematuro. En cuanto a su uso para el proceso normal, la potencialidad está ahí, pero es más de ciencia ficción.
El País-ANGELA BOTO (24 NOV 2004)
Imprime esta entrada